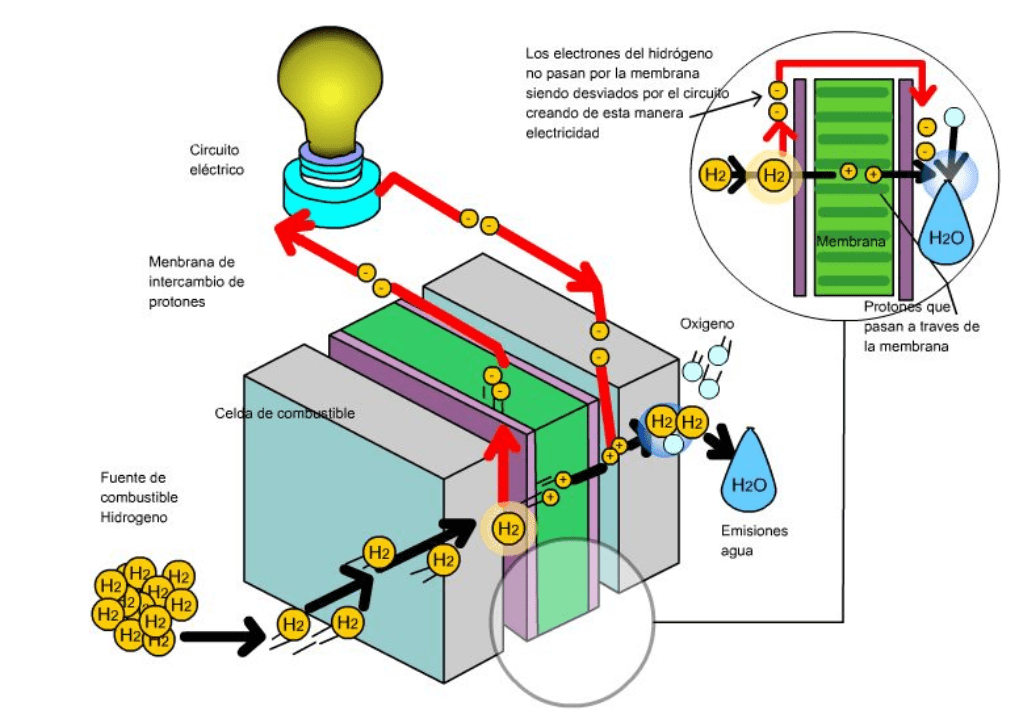
En estos momentos hay muchas esperanzas puestas en las pilas de combustibles como alternativa a las fuentes de energía fósiles. Pero, sabes qué es una pila de combustible y cómo funciona
Una pila de combustible es un dispositivo galvánico que convierte la energía química de un combustible (y un oxidante) en energía eléctrica. Ver figura 1. Dos electrodos catalizados están sumergidos en un electrolito (en este caso ácido sulfúrico, H2SO4) y separados por una barrera de gas. El combustible, en este caso hidrógeno, se hace burbujear a través de la superficie de un electrodo mientras que el oxidante, en este caso oxígeno del aire ambiente, se hace burbujear a través del otro electrodo. Cuando los electrodos se conectan eléctricamente a través de una carga externa, se producen los siguientes efectos:
- El hidrógeno se disocia en la superficie catalítica del electrodo de combustible, formando iones de hidrógeno y electrones.
- Los iones de hidrógeno migran a través del electrolito (y una barrera de gas) hasta la superficie catalítica del electrodo de oxígeno.
- Simultáneamente, los electrones se mueven a través del circuito externo, produciendo una corriente eléctrica, hasta la misma superficie catalítica.
- El oxígeno, los iones de hidrógeno y los electrones se combinan en la superficie catalítica del electrodo de oxígeno para formar agua.
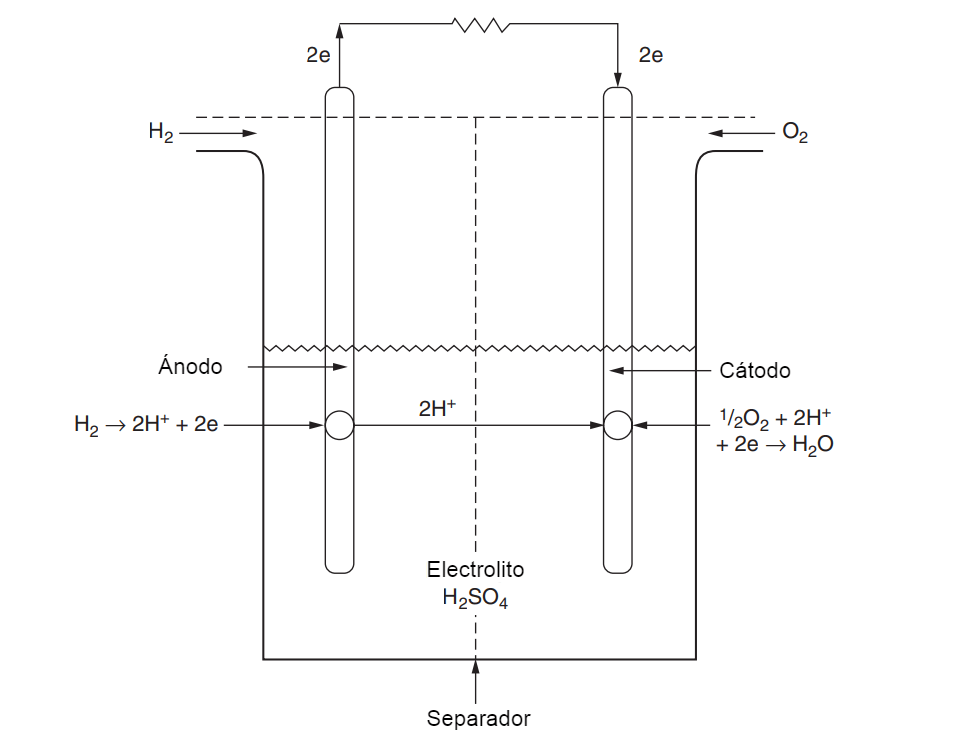
Figura 1: Celda de hidrógeno de electrolito ácido sulfúrico
La diferencia esencial entre una pila de combustible y una batería es la forma de suministrar la fuente de energía química. En una pila de combustible, el combustible y el oxidante se suministran continuamente desde una fuente externa cuando se desea obtener energía. La pila de combustible puede producir energía eléctrica siempre que los reactivos lleguen a los electrodos. En una pila electroquímica, el combustible y el oxidante son parte integrante del dispositivo. La pila dejará de producir energía eléctrica cuando se consuman los reactivos o se deterioren, en el caso de pilas recargables después de un determinado número de ciclos
Existen varios tipos de pilas de combustible según el electrolito empleado:
- Pila de combustible de óxido sólido (SOFC)
- Pila de combustible de carbonato fundido (MCFC)
- Pila de combustible de ácido fosfórico (PAFC)
- Pila de combustible alcalina (AFC)
- Pila de combustible de membrana de intercambio de protones (PEMFC)
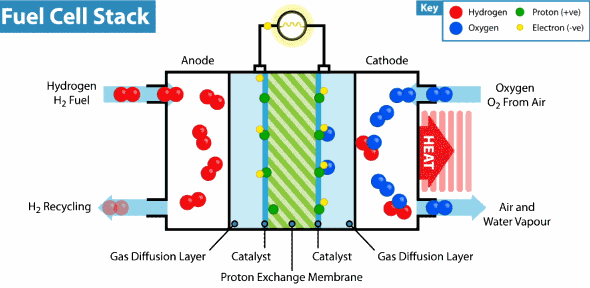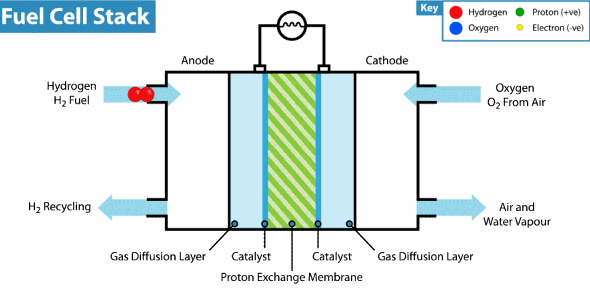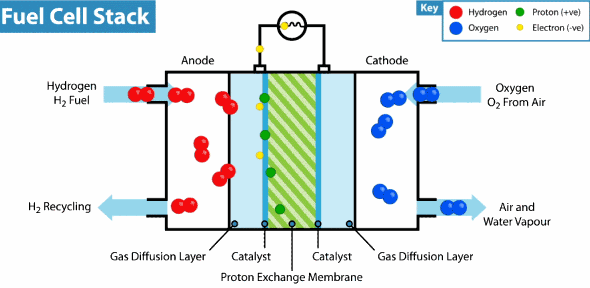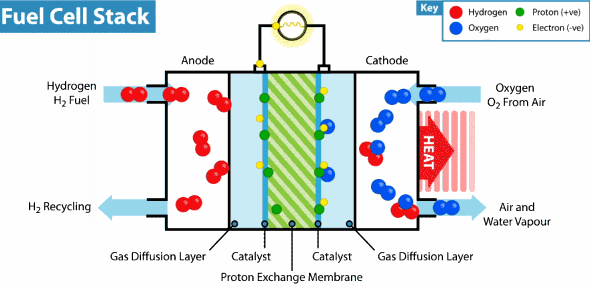
Pila de combustible de membrana de intercambio de protones
Una de las características de las pilas de combustible es que los electrodos pueden alcanzar temperaturas elevadas. Dependiendo del tipo de celda van desde los 70ºC hasta los cerca de 1000ºC en la pila de combustible de óxido sólido en procesos industriales.
La pila de combustible de membrana de protones es la empleada en vehículos, como por ejemplo en carretillas. Veamos cómo funciona este tipo de pilas:
El Hidrogeno entra del lado del ánodo donde se oxida, mientras que el oxígeno entra del lado del cátodo para la reducción, estas celda contienen además electrodos de carbón poroso impregnados con catalizadores metálicos, donde el metal utilizado generalmente es el platino, asimismo contienen una membrana de intercambio de protones, los cuales atraviesan esta membrana del ánodo al cátodo, lo que hace posible la obtención del agua, por otro lado los electrones se mueven por un circuito externo, también del ánodo al cátodo, generando así la electricidad. En la figura se representa el funcionamiento de una celda de intercambio de protones.
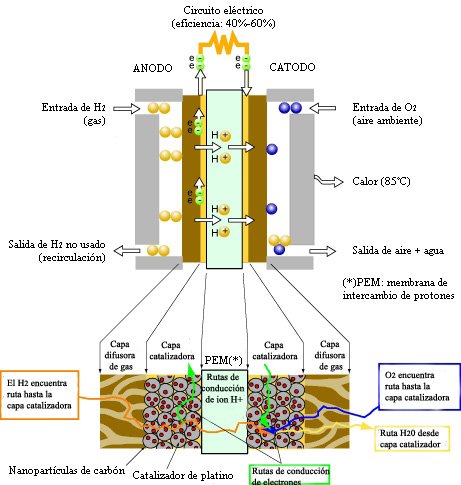
Esquema general de una PEMFC alimentada con hidrógeno (ánodo) y oxígeno (cátodo)

Pila de combustible de membrana de intercambio de protones
